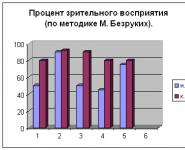
Активная реакция среды. Реакция крови и поддержание ее постоянства
Биохимия
Электронный дидактический комплекс (ЭДК)
Настоящий электронный дидактический комплекс (ЭДК) объединяет в себе несколько функций учебных материалов:
- Информационная текстовая часть учебного курса «биохимия животных с основами физколлоидной химии».
- Наглядные материалы (рисунки, схемы, таблицы).
- Материалы для самоконтроля знаний обучающихся.
В текстовой части кратко изложены основные термины и понятия с выделением ключевых слов. В дополнительный блок ЭДК помещены краткие учебные пособия, методические разработки по биохимии животных.
Составители: з аведующий кафедрой органической и биологической химии Казанской государственной академии ветеринарной медицины доктор ветеринарных наук профессор Хазипов Нариман Залилович, доцент кафедры биохимии Казанского государственного университета Аскарова Альфия Наримановна, доценты кафедры органической и биологической химии Казанской государственной академии ветеринарной медицины доктор биологических наук Логинов Георгий Павлович, Тюрикова Раиса Павловна, Закирова Лилия Азатовна, ассистент кафедры Казанской государственной академии ветеринарной медицины Шилова Светлана Вячеславовна.
Техническое исполнение осуществлено кандидатом ветеринарных наук ассистентом КГАВМ Усольцевым Константином Валерьевичем.
При разработке ЭДК были использованы учебники «Биохимия животных» (Н.З.Хазипов, А.Н.Аскарова, 2003 г.), «Биохимия» (В.П.Козлов, В.Н.Шведова, 2004 г.), «Физическая и коллоидная химия» (М.М.Равич-Щербо, В.В.Новиков, 1975), «Методическое пособие по физической и коллоидной химии» (Р.П.Тюрикова, 2001 г.).
ФИЗИЧЕСКАЯ ХИМИЯ
ВОДА
Как известно, жизнь зародилась в воде и по-прежнему остается тесно связанной с водой. Вода является источником кислорода в атмосфере Земли. Это происходит при фотосинтезе в растениях, при этом энергия света преобразуется в энергию химических связей молекул. Животный мир может использовать только энергию, освободившуюся из этих химических связей в форме АТФ и других трифосфатов.
Вода составляет от 50 до 98% от общей массы организма. Каждая клетка и каждая ткань содержит определенное количество воды, так кожа содержит 72%, сердце – 79%, спинной и головной мозг – 70%, кровь – 79%, лимфа – 96%. С помощью воды осуществляется перенос питательных веществ и продуктов обмена веществ; вода играет важную роль в осмотических явлениях, в сохранении коллоидного состояния протоплазмы и т.д.
Вода обеспечивает растворение веществ, процессы всасывания, передвижения, набухания, осмоса и многих других. Высокая теплоемкость, теплопроводность, теплота испарения воды способствует поддержанию температуры тела у теплокровных животных. Она участвует в реакциях гидролиза, вызывает диссоциацию молекул (электролитов). Вода – конечный продукт обмена веществ в организме
Уникальные свойства воды Н 2 О становятся очевидными при сравнении с метаном (СН 4). Обе молекулы одинаковы по массе и размерам. Тем не менее температура кипения воды на 250°С выше по сравнению с температурой кипения метана. В результате вода на поверхности Земли находится в жидком, а метан – в газообразном состоянии. Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды. Молекула воды имеет форму тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра заняты свободными электронными парами атома кислорода, а остальные две – атомами водорода. Поэтому связи Н-О-Н расположены под углом друг к другу. Кроме того, из-за высокой электроотрицательности атома кислорода связь О-Н полярна. т. е. молекула воды представляет собой электрический диполь .
Каждая молекула тетраэдрически координирована с четырьмя другими молекулами воды, благодаря водородным связям энергия диссоциации водородной связи составляет 25 кДж/моль.
Биполярное строение молекул воды благоприятствует образованию водородных связей. Поэтому у воды в жидком состоянии многие молекулы связаны между собой водородными «мостиками». Часто образуются тетраэдрические структуры, так называемые "кластеры" воды. Поскольку в твердом состоянии расстояние между молекулами в среднем больше, чем в жидкости, плотность льда меньше по сравнению с плотностью воды. Это свойство воды очень важно в экологическом отношении, т.к. зимой на поверхности водоемов образуется слой льда, и они редко промерзают до дна.
Вода имеет высокую константу диэлектрической проницаемости, т.е. в воде электростатическое притяжение двух противоположно заряженных ионов снижается примерно в 80 раз.
В этом полярном растворителе (воде) хорошо растворяются полярные молекулы. Они окружаются молекулами воды, происходит гидратация молекул.
Электростатические силы притяжения удерживают молекулы воды, тем самым разрушая межионные или внутримолекулярные связи самой гидратированной молекулы.
Рис.1.1. Электростатические силы притяжения
АКТИВНАЯ РЕАКЦИЯ ВОДНЫХ РАСТВОРОВ
Под активной реакцией среды понимают концентрацию водородных ионов. В числе различных физико-химических защитных констант организма таких, как изотермия, изотония и другие постоянство концентрации водородных ионов – изогидрия – имеет особо важное значение для биологических процессов организма. Физико-химическое состояние белков, каталитическая функция ферментов, активность солевых ионов зависят от концентрации ионов водорода.
Активная реакция крови, обусловленная концентрацией в ней водородных (Н") и гидроксильных (ОН") ионов, имеет чрезвычайно важное биологическое значение, так как процессы обмена протекают нормально только при определенной реакции.
Кровь имеет слабо щелочную реакцию. Показатель активной реакции (рН) артериальной крови равен 7,4; рН венозной крови вследствие большего содержания в ней углекислоты равен 7,35. Внутри клеток рН несколько ниже и равен 7 - 7,2, что зависит от метаболизма клеток и образования в них кислых продуктов обмена.
Активная реакция крови удерживается в организме на относительно постоянном уровне, что объясняется буферными свойствами плазмы и эритроцитов, а также деятельностью выделительных органов.
Буферные свойства присущи растворам, содержащим слабую (т. е. малодиссоциированную) кислоту и ее соль, образованную сильным основанием. Прибавление к подобному раствору сильной кислоты или щелочи не вызывает такого большого сдвига в сторону кислотности или щелочности, как в том случае, если прибавить то же количество кислоты или щелочи к воде. Это объясняется тем, что прибавленная сильная кислота вытесняет слабую кислоту из ее соединений с основаниями. В растворе при этом образуется слабая кислота и соль сильной кислоты. Буферный раствор, таким образом, препятствует сдвигу активной реакции. При добавлении к буферному раствору сильной щелочи образуется соль слабой кислоты и вода, вследствие чего возможный сдвиг активной реакции в щелочную сторону уменьшается.
Буферные свойства крови обусловлены тем, что в ней содержатся следующие вещества, образующие так называемые буферные системы: 1) угольная кислота - двууглекислый натрий (карбонатная буферная система)-, 2) одноосновный - двухосновный фосфорнокислый натрий (фосфатная буферная система), 3) белки плазмы (буферная система белков плазмы)-, белки, будучи амфолитами, способны отщеплять как водородные, так и гидроксильные ионы в зависимости от реакции среды; 4) гемоглобин - калийная соль гемоглобина (буферная система гемоглобина). Буферные свойства красящего вещества крови - гемоглобина - обусловлены тем, что он, будучи кислотой более слабой, чем H 2 CO 3 , отдает ей ионы калия, а сам, присоединяя Н"-ионы, становится очень слабо диссоциирующей кислотой. Примерно 75% буферной способности крови обусловлено гемоглобином. Карбонатная и фосфатная буферные системы имеют для сохранения постоянства активной реакции крови меньшее значение.
Буферные системы имеются также в тканях, благодаря чему рН тканей способен сохраняться на относительно постоянном уровне. Главными буферами тканей являются белки и фосфаты. Вследствие наличия буферных систем образующиеся в клетках в ходе процессов обмена веществ углекислота, молочная, фосфорная и другие кислоты, переходя из тканей в кровь, не вызывают обычно значительных изменений ее активной реакции.
Характерным свойством буферных систем крови является более легкий сдвиг реакции в щелочную, чем в кислую сторону. Так, для сдвига реакции плазмы крови в щелочную сторону приходится прибавлять к ней в 40-70 раз больше едкого натра, чем к чистой воде. Для того же чтобы вызвать сдвиг ее реакции в кислую сторону, к ней необходимо добавить в 327 раз больше соляной кислоты, чем к воде. Щелочные соли слабых кислот, содержащиеся в крови, образуют так называемый щелочной резерв крови. Величину последнего можно определить по тому количеству кубических сантиметров углекислоты, которое может быть связано 100 мл крови при давлении углекислоты, равном 40 мм рт. ст., т. е. приблизительно соответствующем обычному давлению углекислоты в альвеолярном воздухе.
Так как в крови имеется определенное и довольно постоянное отношение между кислотными и щелочными эквивалентами, то принято говорить о кислотно-щелочном равновесии крови.
Посредством экспериментов над теплокровными животными, а также клиническими наблюдениями установлены крайние, совместимые с жизнью пределы изменений рН крови. По-видимому, такими крайними пределами являются величины 7,0-7,8. Смещение рН за эти пределы влечет за собой тяжелые нарушения и может привести к смерти. Длительное смещение рН у человека даже на 0,1-0,2 по сравнению с нормой может оказаться гибельным для организма.
Несмотря на наличие буферных систем и хорошую защищенность организма от возможных изменений активной реакции крови, сдвиги в сторону повышения ее кислотности или щелочности все же иногда наблюдаются при некоторых условиях как физиологических, так в особенности патологических. Сдвиг активной реакции в кислую сторону называется ацидозом, сдвиг в щелочную сторону - алкалозом.
Различают компенсированный и некомпенсированный ацидоз и компенсированный и некомпенсированный алкалоз. При некомпенсированном ацидозе или алкалозе наблюдается действительный сдвиг активной реакции в кислую или щелочную сторону. Это происходит вследствие исчерпания регуляторных приспособлений организма, т. е. тогда, когда буферные свойства крови оказываются недостаточными для того, чтобы воспрепятствовать изменению реакции. При компенсированном ацидозе или алкалозе, которые наблюдаются чаще, чем некомпенсированные, не происходит сдвига активной реакции, но уменьшается буферная способность крови и тканей. Понижение буферности крови и тканей создает реальную опасность перехода компенсированных форм ацидоза или алкалоза в некомпенсированные.
Ацидоз может возникнуть, например, вследствие увеличения содержания в крови углекислоты или вследствие уменьшения щелочного резерва. Первый вид ацидоза -газовый ацидоз наблюдается при затрудненном выделении углекислоты из легких, например при легочных заболеваниях. Второй вид ацидоза негазовый, он встречается при образовании в организме избыточного количества кислот, например при диабете, при почечных болезнях. Алкалоз также может быть газовым (усиленное выделение CO 3) и негазовым (увеличение резервной щелочности).
Изменения щелочного резерва крови и незначительные изменения ее активной реакции всегда происходят в капиллярах большого и малого круга кровообращения. Так, поступление большого количества углекислоты в кровь тканевых капилляров вызывает закисление венозной крови на 0,01-0,04 рН по сравнению с артериальной кровью. Противоположный сдвиг активной реакции крови в щелочную сторону происходит в легочных капиллярах в результате перехода углекислого газа в альвеолярный воздух.
В сохранении постоянства реакции крови имеет большое значение деятельность дыхательного аппарата, обеспечивающего удаление избытка углекислоты путем усиления вентиляции легких. Важная роль в поддержании реакции крови на постоянном уровне принадлежит также почкам и желудочно-кишечному тракту, выделяющим из организма избыток как кислот, так и щелочей.
При сдвиге активной реакции в кислую сторону, почки выделяют с мочой увеличенные количества кислого одноосновного фосфата натрия, а при сдвиге в щелочную сторону происходит выделение с мочой значительных количеств щелочных солей: двухосновного фосфорнокислого и двууглекислого натрия. В первом случае моча становится резко кислой, а во втором - щелочной (рН мочи в нормальных условиях равен 4,7- 6,5, а при нарушениях кислотно-щелочного равновесия может достигать 4,5 и 8,5).
Выделение относительно небольшого количества молочной кислоты осуществляется также потовыми железами.
Нередко считают, что показатель pH измеряет кислотность воды. Это не верно: величина pH - мера концентрации ионов водорода в воде. По значению pH судят кислая вода, нейтральная или щелочная. А кислотность и щелочность воды - это другие понятия. Содержание рыб в воде с неподходящим для них значением pH может привести к ацидозу (если вода слишком кислая) или к алкалозу (если вода слишком щелочная).
Зачастую без знания величины pH невозможно поставить диагноз больной рыбе, невозможно грамотно применять лекарственные препараты, невозможно наладить процессы биофильтрации воды и восстановить сбившееся в аквариуме.
Из всех искусств для аквариумиста наиважнейшим является искусство измерения pH !!! - Один из авторов этого материала - Елена Ковалёва (модератор ), не перестает это снова и снова повторять всем аквариумистам-новичкам.
К сожалению, не все верят на слово, утверждая: " Зачем с тестами заморачиваться. Вот у меня папа (мама) аквариум сколько лет держал, никогда ничего не измерял, а рыбки жили, да еще и плодились-то как! И вообще, вода у нас чистая, прозрачная!" - И только тогда, когда "неразрешимые" аквариумные проблемы начинают нарастать лавиной, а печальные рыбьи похороны входят у такого "любителя" в обычную и чуть ли не ежедневную практику, он начинает-таки понемногу осваивать аквариумную гидрохимию.

Фото 1
.
Все раки: и большие (зебровый - вверху), и маленькие (карликовый мексиканский - внизу) не любят кислой воды. Мягкая вода действительно быстро подкисает (pH воды падает, когда в аквариуме интенсивно идут процессы нитрификации). Куски пористого известняка (к примеру, известкового туфа) вполне эффективно подщелачивают мягкую питерскую воду - стабилизируют значения pH. Если решили содержать раков и крабов, то обязательно научитесь контролировать pH в своем аквариуме.

Фото 2. Оранжевый карликовый (Cambarellus patzcuarensis "orange") не любит низких значений pH.
Видео 1. В оптимальных для себя условиях мексиканские карликовые раки бойкие и решительные создания: "Кыш отсюда! Это моя норка!". Рекомендуем завести.
Итак, для того, чтобы успешно содержать многих интересных обитателей аквариума необходимо научиться контролировать значение показателя pH. А для этого сначала надо pH измерить. А измерить активную реакцию воды (иначе говоря показатель pH) не просто, а очень просто! Для этого есть . Они производятся многими фирмами, в последнее время и отечественными тоже (это совсем недорогие от НИЛПА). Все они позволяют с достаточной для аквариумиста-любителя точностью очень быстро определить значение pH. Для этого надо лишь добавить одну-две капли специального индикатора к пробе воды и затем сравнить цвет пробы с соответствующей цветовой шкалой. Какими тестами для измерения pH удобнее всего и лучше всего пользоваться, и какие важные детали нужно знать рассказано в .
За исключением специальных случаев, пригодной для аквариумных целей в пресноводной аквариумистике можно считать воду с активной реакцией 6.4-8.3. Более высокие значения в рамках указанного диапазона (слабощелочная вода) предпочитают рыбы из Великих Африканских озер, более низкие (кислая вода) - рыбы из бассейна Амазонки и водоемов тропических дождевых лесов Африки и Азии. Однако, многие рыбы, на воле обитающие в кислой воде, в аквариуме способны жить в более щелочной. Например, неонов и скалярий из Амазонии вполне устроит вода, значения pH которой достигают 8. Важно лишь избегать резких колебаний величины pH. А что можно считать резким колебанием? Отвечая на этот вопрос надо иметь в виду, что по своей сути показатель pH отражает содержание в воде ионов водорода, причем показатель этот логарифмический. Поэтому его изменение на одну единицу соответствует изменению концентрации этих ионов в 10 раз. Так что такое, казалось бы, незначительное - всего на единичку - изменение активной реакции воды может вызвать у рыб стресс. Быстрое (за 10 - 20 минут) изменение pH
на 2 единицы с высокой вероятностью приведет к необратимым изменениям жабр рыб и их постепенному разрушению. Испытав подобную передрягу, рыбы могут погибнуть, причем иной раз это происходит не сразу, а спустя несколько дней.
Показатель pH
может быть чрезвычайно подвижным и заметно изменяться в аквариуме в течении суток, если этот аквариум , или вода в аквариуме цветет. Кроме того, значения активной реакции воды, только что налитой из-под крана, отстоянной и аквариумной могут сильно отличаться друг от друга. Поэтому однажды измерив значение
pH
воды, взятой из-под крана, нельзя считать, что эта величина раз и навсегда установлена для всего вашего аквариумного хозяйства.
Мы специально подчеркиваем это обстоятельство, так как не раз встречали людей поступивших именно так. Особенно заметны эти колебания в мягкой воде с незначительной . Такая вода, к примеру, течет из водопроводных кранов в большинстве районов Санкт-Петербурга. Если сразу же измерить её активную реакцию, то получаются значения близкие к 6.2-6.4. После отстаивания в течении нескольких дней значения pH
обычно вырастают до 7.0-7.2. В аквариуме с гранитным или базальтовым (не " ") грунтом мягкая питерская вода постепенно становится все более кислой. Если в аквариуме с такой водой не делать , то спустя месяц можно получить величины порядка 5.0-5.5. Вода при этом остается, как говорится, "чистой и прозрачной", а рыбки... они вполне могут выжить (если только это не малавийские и таньганийские цихлиды и не живородки). Некоторую убыль рыбьего населения (понятно, что в таких условиях она неизбежна) незадачливый любитель-аквариумист вскоре решает пополнить в ближайшем зоомагазине. Он покупает рыб тех же видов, что у него уже есть, затем торопится домой и выливает содержимое транспортировочного пакета в аквариум. Случается страшное… Оказавшись на новом месте, рыбы тут же
поджимают плавники
, потом начинают метаться по аквариуму, судорожно вздрагивать, пытаться выпрыгнуть из него и вскоре в конвульсиях погибают. Аквариумист недоволен: ему, очевидно, продали каких-то бракованных рыб. Он складывает их опять в пакет, на всякий случай (вдруг оживут?) наливает туда воду из аквариума и относит обратно в магазин. Мы рассказываем не гипотетическую, но случившуюся в реальной жизни историю, поэтому знаем как повел себя продавец. Он протестировал принесенную воду и объяснил начинающему аквариумисту в чем дело. Вода в его аквариуме сильно закисла. Был дан совет купить и положить в аквариум известковый туф (основным компонентом этого пористого камня является карбонат кальция, который постепенно растворяясь, подщелачивает воду; куски известкового туфа показаны на фото 1 и 2 в начале этой статьи), через день понемногу и конечно же регулярно измерять pH
. Активная реакция воды нормализовалось в течение следующей недели и в дальнейшем этот аквариумист - теперь уже отнюдь не новичок, успешно содержал в своем аквариуме многих рыб, в том числе и капризных.
А в самом деле, можно ли новых рыб сразу переселять из пакета в аквариум? Даже если вы убедились, что и активная реакция воды в вашем аквариуме и в пакете для транспортировки рыбы очень близки друг к другу, то делать этого всё равно не стоит. По своему химическому составу () вода может значительно различаться и тогда простая пересадка рыбы (без процедуры
) вызовет у неё сильную стрессовую реакцию (хотя, скорее всего, не убьет её). Такая рыба в дальнейшем может заболеть, к примеру,
ихтиофтириозом . Если pH
и температура воды в аквариуме и той воды, в которой рыба транспортировалась, отличаются друг от друга незначительно (рН не более чем на 0.5 единицы), то время, которое нужно потратить на перевод рыбы будет небольшим - около 15 минут. Но если, показатели активной реакции воды исходно различались на целую единицу и более, то скорость перевода должна быть заметно медленнее. Для того, чтобы перевести рыбу из воды с pH
=6.0 в воду с pH
=7.0 потребуется не менее получаса, а для чувствительных видов этот процесс займет еще больше времени.
Ацидоз рыб и его симптомы
При продолжительном содержании в чрезмерно кислой для данного вида воде у рыб развивается патологическое состояние (болезнь) - ацидоз .
Симптомы ацидоза таковы:
Рыбы становятся вялыми, отказываются от корма, их окраска темнеет, они плавают с поджатыми плавниками, подолгу замирают в зарослях растений или в укромных уголках аквариума у дна. Там же и умирают. Рот и жаберные крышки погибших рыб оказываются плотно закрытыми, а тело нередко изгибается. Кожные покровы еще живых рыб покрываются беловатой густой слизью, жабры с краев делаются коричневатыми. Рыбы испытывают постоянное кислородное голодание, но дышат медленно, с трудом (О том, почему при ацидозе организму рыбы не хватает кислорода есть ). Рыбы могут почесываться о растения и камни на дне. Они могут неожиданно резко вздрагивать и кашлять. Естественно, в таком состоянии ваши питомцы долго не проживут. При не слишком сильном хроническом снижении показателя pH все эти симптомы едва заметны, но у молоди нередко развивается сколиоз (искривление позвоночника) и деформируются или укорачиваются жаберные крышки, у самцов гуппи плохо растут или расщепляются и измочаливаются их роскошные хвосты. Рыбы, живущие в чрезмерно кислой для себя воде или неожиданно оказавшиеся в таковой, часто заболевают хилодонеллёзом , гиродактилёзом , , микобактериозом .

Фото 3.
Признаки ацидоза у китайского красного карася (исходная форма ). Стрелочками отмечены скопление густой белой слизи на рыле рыбы, белые "точки" на теле - это тоже комочки слизи, кроме того, белые валики слизи видны под спинным плавником. Спинной плавник опущен, остальные плавники поджаты.
Что делать, если вы обнаружили у своих рыб ацидоз?
Начинайте плавно поднимать pH воды. Для этого надо начать (убедитесь, что подготовленная для подмены вода более щелочная!). За один раз можно подменить 10 - 20% от всего объема воды в аквариуме, не допуская резкого скачка pH вверх. Подмены надо делать каждый день (можно дважды в день с интервалом в 6-8 часов) до тех пор, пока pH не достигнет желаемого уровня. Кроме того, для борьбы с ацидозом можно воспользоваться (в настоящее время они не дороги, так как стали производиться в России) или обычной пищевой содой, понемногу (не более чем по половине чайной ложки на каждые 50 л воды) внося её в аквариум. Соду надо предварительно растворить в небольшом объеме (например, в стакане) теплой воды и вливать раствор в аквариум постепенно в течение получаса. В это время аэрацию аквариума надо сделать как можно более сильной. В течение 4 часов можно поднять значение показателя pH на одну единицу.
Если во время содержания при неблагоприятных для себя условиях рыбы ничем не заболели, то специального лечения для них не потребуется, но быстрому восстановлению их кожных покровов и жабр будет способствовать внесение в воду дубильных веществ (отвар коры дуба, ), пимафикса () и . Плавное повышение
кальциевой жесткости воды на 2 - 4°
GH также улучшит функциональное состояние рыб.
Алкалоз и его симптомы
При содержании рыб в слишком щелочной воде, они начинают страдать от алкалоза . При этом тело рыб, также как и при ацидозе, покрывается слизью, но слизь эта не вязкая, наоборот, она оказывается разжиженной и легко стекает или смывается с мертвых или умирающих рыб. Поверхность тела рыб становится тусклой, плавают они с растопыренными плавниками и жаберными крышками, дыхание учащенное. Возможно сильное расширение кровеносных сосудов, очаговые кровоизлияния и даже кровотечение из жабр. Межлучевые перепонки рыб разрушаются и их плавники выглядят разволокнеными, у многих видов начинает мутнеть роговица глаз.
Что делать, если вы обнаружили у своих рыб алкалоз?
Лечат алкалоз плавным снижением pH воды. Для этого используют специальные (pH-), соляную, серную и ортофосфорную кислоты. Как и в случае с ацидозом, рыбам помогут поливитамины и дубильные вещества, а также поддержание достаточной кальциевой жесткости воды (но не карбонатной! ).
Содержание рыб в щелочной воде способствует развитию у них опасного заболевания .
Острый алкалоз может развиться у рыб за несколько часов в густо засаженном растениями и очень хорошо освещенном аквариуме с мягкой водой. О том, почему это происходит рассказано в другой
статье
.
О современных средствах стабилизации pH воды в аквариуме можно узнать в .
Думаем, что сомнений о том, надо ли аквариумисту знать величину показателя pH в своем аквариуме у читателя не осталось. Надо!!! А о том, какой тест для определения pH лучше купить и как измерять рассказано в статье "
Концентрация водородных ионов в среде (почве, воде); рН. При рН 7 среда нейтральная, ниже 7 - кислая, выше 7 - щелочная. Активная реакция среды - один из основных абиотических факторов. Изменяя проницаемость наружных мембран клеток, рН влияет на водно-солевой обмен организмов. Различают стеноионные виды
, обитающие в водах с колебаниями рН, например, в пределах 5-6, и эвриионные виды
, выдерживающие большие изменения этого фактора. С возрастом устойчивость организмов к сдвигу рН повышается (так, молодые особи рачка Gammarus pulex в воде с рН 6-6,2 погибают через 1,5-2 суток, а более крупные - через 5). От рН воды зависит устойчивость гидробионтов к токсическим веществам.
Экологический энциклопедический словарь. - Кишинев: Главная редакция Молдавской советской энциклопедии . И.И. Дедю . 1989 .
Смотреть что такое "АКТИВНАЯ РЕАКЦИЯ СРЕДЫ" в других словарях:
РЕАКЦИЯ СРЕДЫ - РЕАКЦИЯ СРЕДЫ, термин, употребляемый в химии и характеризующийся соотношением водородных и гидроксильных ионов. Р. с. является кислой, если в растворе преобладают водородные ионы; раствор обнаруживает в атом случае свойства к^гы. В случае… …
См. в ст. Активная реакция среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
ФЕРМЕНТЫ - (син. энзимы; франц. диастазы), биол. агенты, катализирующие большинство хим. реакций, лежащих в основе жизнедеятельности клетки и организма. Ряд характерных свойств термолябильность, специфичность действия, высокая каталитическая эффективность,… … Большая медицинская энциклопедия
- (от лат. fermentum – закваска) энзимы, специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме и в своём закономерном сочетании составляющие его Обмен… …
ОБЛИТЕРАЦИЯ - (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
ЛЮМИНИСЦЕНЦИЯ - (от лат. lumen свет), «холодное свечение», обусловленное не повышением t° (тепловое или температурное излучение), но различными иными причинами. В зависимости от способа возбуждения свечения различают несколько видов Л. Таковы: 1) … Большая медицинская энциклопедия
УГЛЕКИСЛОТА - встречается в воде водоема в нескольких видах: свободная, бикарбонатная и монокарбонатная. Количество свободной У. является показателем загрязнения воды органическими веществами; увеличение ее до 30 мл/л вредно для рыб (вызывает у них учащенное… … Прудовое рыбоводство
Жидкая ткань, циркулирующая в кровеносной системе человека и животных; обеспечивает жизнедеятельность клеток и тканей и выполнение ими различных физиологических функций. Одна из основных функций К. транспорт газов (O2 от органов… … Большая советская энциклопедия
Густой, труднопроходимый широколиственно темнохвойный многоярусный заболоченный или переувлажненный лес. Термин обычно применяется к европейским лесам (например, Беловежская пуща, Налибокская пуща). рН СРЕДЫ, см. Активная реакция среды.… … Экологический словарь
Виды, выдерживающие большие изменения рН среды (например, личинки комара Chironomus, способные выдерживать колебания рН от 2 до 10, рачки Cyclops languidus и Chydorus ovalis, коловратки Anuraea cochlearis и др.). Ср. Стеноионные виды. См. также… … Экологический словарь
Из курса химии каждый из нас помнит формулы хотя бы нескольких молекул. Даже если вы не знаете самих принципов химии, то наверняка у вас в памяти отложилась одна символическая запись - Н2О, обозначающая, что молекула воды состоит из двух атомов водорода, соединенных с атомом кислорода. Но такая молекула является химически неактивной, то есть не может вступать в реакции с другими веществами. Этот процесс возможен лишь при распаде молекул на ионы.
Не все, но определенная часть молекул воды диссоциирует на положительно заряженный катион Н+ и анион с отрицательным зарядом ОН-. Такое разделение и соединение в полную молекулу происходит постоянно, одна часть молекул распадается на ионы, а другая в это время соединяется воедино. В химически чистой воде при комнатной температуре 1/10 000 000 часть от общего числа молекул постоянно находится в диссоциированном состоянии.
Доля диссоциированных молекул может увеличиваться или уменьшаться. Колебания температуры на это явление не воздействуют, по крайней мере в пределах комнатной температуры число молекул остается прежним. Зато добавки других веществ, растворяемых в воде, сильно влияют на количество частиц.
Воздействие, оказанное на степень диссоциации, может быть троякое:
- Растворенное вещество не изменяет долю диссоциированных молекул. Например, вы можете растворить в воде кухонную соль (NaCl), которая продиссоциирует на ионы Na+ и С1-. Доля ионов Н+ и ОН-, составляющих воду, при этом не изменится.
- Растворенное вещество увеличивает концентрацию ионов Н+. Например, молекулы фосфорной кислоты Н2РО3 также продиссоциируют на два иона Н+ и один РО3-. А значит, количество ионов Н+ в растворе воды и фосфорной кислоты станет больше, в то время как число ионов ОН- не изменится.
- Растворенное вещество увеличивает концентрацию ионов ОН-. Например, молекулы едкого натрия (NaOH) образуют ионы Na+ и ОН-. В этом случае концентрация ионов Н+ не изменится, а ионов ОН- в растворе станет больше.
На этом можно окончить насыщенный сложными терминами пролог и сделать основные выводы. Избыток Н+ придает воде кислотные свойства, а избыток ОН- - щелочные. Там, где доля диссоциированных молекул не изменилась, вода имеет нейтральные свойства. В целом, подобная характеристика воды называется активной реакцией.
Чтобы оценить активную реакцию в цифрах, применяют так называемый водородный показатель. Он равен антилогарифму ионов Н+ в растворе, то есть для химически чистой воды antilog (1/10 000 000) = 7. Для тех, кто не очень дружит с математикой и не знает, что такое антилогарифм, обращаю внимание на количество нолей в доле диссоциированных молекул воды - оно совпадает с величиной водородного показателя. Сокращенно величину водородного показателя нейтральной воды записывают как рН 7. Сокращение рН означает pondus hydrogenii, что переводится с латинского языка как "водородный показатель".
В самом общем смысле при рН 7 вода обладает нейтральными свойствами, при рН 7 - щелочная. Для более точного указания свойств воду называют:
- рН 1-3 - сильнокислой;
- рН 3-5 - кислой;
- рН 5-7 - слабокислой;
- рН 7 - нейтральной;
- рН 7-9 - слабощелочной;
- рН 9-11 - щелочной;
- рН 11-14 - сильнощелочной.
В приведенном выше примере список различных веществ, изменяющих водородный показатель, далеко не исчерпан. Все они, независимо от химического состава, оказывают влияние на эту величину. Понижают ее (или, иными словами, подкисляют воду) кислоты и их соли. Повышению водородного показателя способствует наличие в воде щелочей или щелочных солей. Часть веществ не изменяет величину водородного показателя - это нейтральные вещества.
В аквариумной практике давно применяются несколько веществ, способных повлиять на активную реакцию. Например, снижение величины рН производят с помощью кислого отвара торфа. Такое же действие имеет растворенный в воде углекислый газ. При разведении аквариумных рыбок нередко используют и ортофосфорную кислоту. Повышение величины водородного показателя производят с помощью раствора питьевой соды (Nа2НСОз). Как вы понимаете, подкислить или подщелочить воду можно любым веществом, обладающим соответствующими свойствами, но для использования в аквариуме оно не должно быть ядовитым. Поэтому приведенный список применяемых в аквариумистике веществ можно считать исчерпанным.
Нередко, говоря о водородном показателе воды, аквариумисты употребляют термины "кислотность" или "щелочность". При этом они применяют их так, будто увеличение кислотности - это то же самое, что снижение водородного показателя, и наоборот. На самом же деле это ошибка. Кислотностью называют количество кислотных остатков в воде и измеряют в мг/л, а это значит, что одна и та же кислотность может соответствовать различным значениям водородного показателя, смотря какой именно силой обладает этот кислотный остаток. Например, в одной пробе в одинаковой концентрации растворена угольная кислота, а в другой - соляная. Так как кислотные свойства соляной кислоты в сотни раз сильнее, чем угольной, то водородный показатель в растворе соляной кислоты будет намного ниже, а кислотность растворов станет при этом одинаковой. То же самое можно сказать и о щелочности. Эти термины в аквариумной практике лучше не использовать вообще.
И. Шереметьев